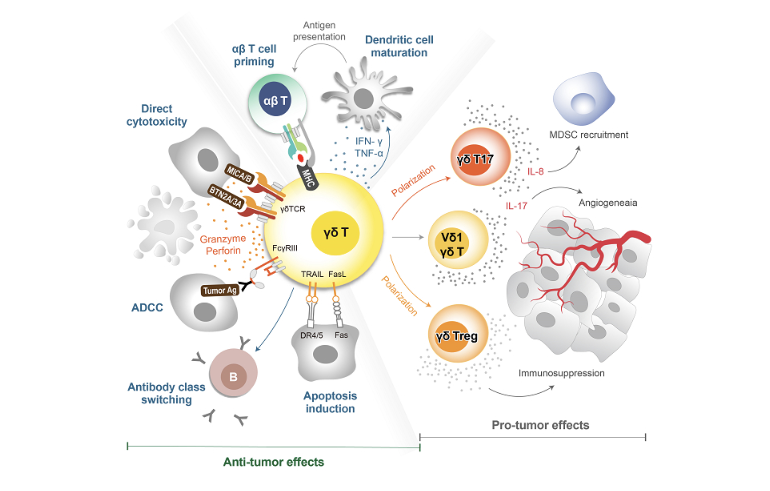
ADC의 DAR 분석서비스

고마바이오텍에서는 ADC 연구시, DAR (Drug to Antibody ratio) 즉, 항체 하나당 약물이 몇개 붙어 있는지 측정하는 서비스를 제공합니다. 1. HIC HPLC 분석 HIC-HPLC라는 정밀 분석 기술을 사용하여, 항체-약물 접합체(ADC)나 바이오폴리머(생체고분자) 결합물이 얼마나 잘 만들어졌는지 검사해 주는 서비스입니다. 1. 무엇을 분석하나요? 가장 핵심은 DAR (Drug-to-Antibody Ratio), 즉 "항체 하나당 약물이 몇 개나 붙어 있는가"를 측정하는 것입니다. 항체라는 '배달 트럭'에 암세포를 죽이는 '폭탄(약물)'을 실어 보낸다고 가정해 봅시다. 트럭마다 폭탄이 2개 실린 것도 있고, 4개 실린 것도 있고, 아예 안 실린 빈 트럭도 있을 수 있습니다. 이 서비스는 폭탄이 몇 개씩 실린 트럭이 각각 얼마나 있는지를 정확하게 분류해서 비율을 알려줍니다. 2. 어떤 기술을 쓰나요? (HIC-HPLC) HIC(Hydrophobic Interaction Chromatography)라는 기술을 사용합니다. 보통 항체에 약물이 많이 붙을수록 물을 싫어하는 성질(소수성)이 강해집니다. 이 성질의 차이를 이용해 액체 크로마토그래피(HPLC) 장비로 성분들을 하나하나 분리해내는 방식입니다. 3. 이 서비스가 왜 필요한가요? 품질 관리: 약물이 너무 적게 붙으면 효과가 없고, 너무 많이 붙으면 몸속에서 독성을 일으키거나 뭉칠 수 있습니다. 적정량이 잘 붙었는지 확인해야 합니다. 안정성 확인: 시간이 지나도 약물이 항체에서 떨어지지 않고 잘 붙어 있는지 확인하는 지표가 됩니다. 데이터 확보: 신약 개발 과정에서 연구소나 제약사가 공식적으로 제출할 수 있는 정밀한 분석 데이터(그래프와 수치)를 제공합니다. 2. MALDI-TOF MS 분석 MALDI-TOF MS라는 질량 분석 기술을 사용하여, 항체-약물 접합체(ADC)나 단백질 결합물의 정확한 분자량을 측정하고 이를 통해 약물이 몇 개...