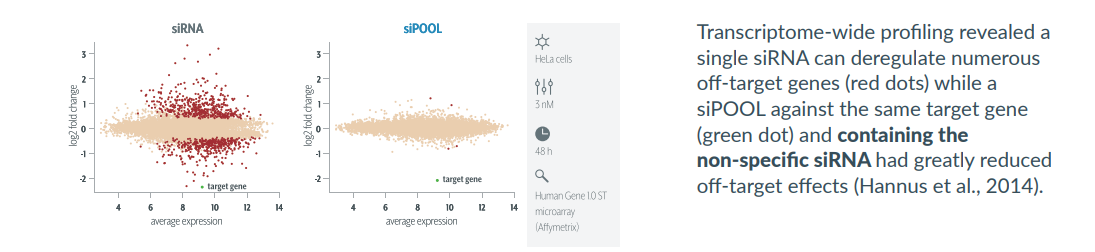
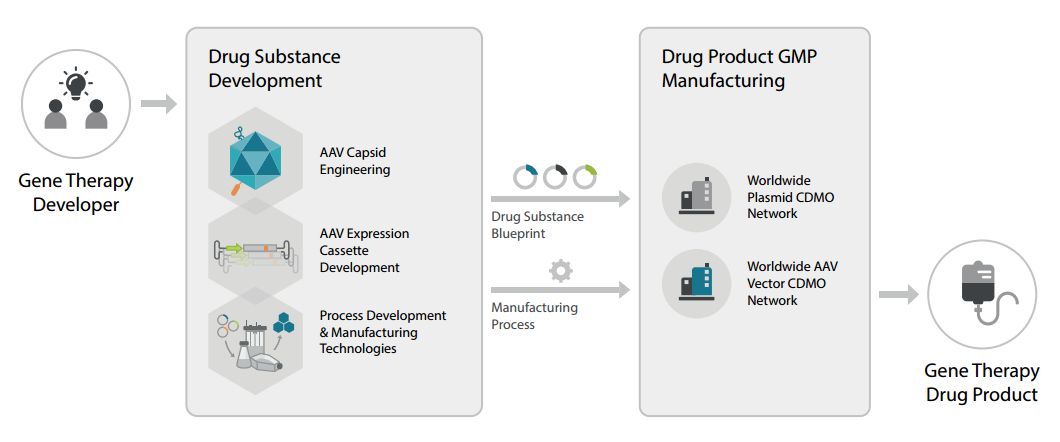
단백질 발현에 이용되는 주요 플랫폼은 박테리아(E.coli),곤충(Baculovirus), mammalian cell (포유동물 세포) 입니다. 표적 단백질은 활성, 기능, 접힘, 번역후 변형 (PTM, Post-translational modification), 서열 및 구조 등이 모두 다르기 때문에, 이러한 특징에 따라 가장 적합한 발현 시스템을 선택하여야 합니다. E.coli 발현 플랫폼 E.coli는 가장 일반적으로 사용되는 단백질 발현 시스템 중 하나이며, 일반적으로 DNA plasmid 발현 벡터를 이용하여 유도됩니다. E.coli는 일반 실험실 조건에서 쉽게 배양할 수 있고, 비교적 간단하며 신속하게 발현할 수 있습니다. 표적 단백질이 원핵생물 시스템에서 유래하는 경우에는 E.coli가 적합하나, 단백질이 진핵생물 기원인 경우, 이 시스템에서 PTM을 보장할 수 없으며 다른 시스템을 사용하는 것이 더 효과적일 수 있습니다. 물론 PTM이 중요하지 않은 경우에는 진핵생물의 단백질 발현에도 좋은 플랫폼이 될수 있습니다. Milestone 1. Gene synthesis, Cloning, Plasmid Prep : 유전자합성, 코돈 최적화, expression vector에 cloning, Plasmid prep 2. Protein Expression Evaluation : plasmid를 bacterial expression strain에 transform. 발현 평가 및 최적화 3. Protein Purification, Tag Removal & Refolding (optional) : 단백질 정제 4. QC & Delivery : purity 분석 및 정량 Baculovirus/Insect 발현 플랫폼 Baculovirus/Insect 발현 시스템은 E.coli나 효모에서 발현할 수 없는 고품질 glycosylated protein의 발현에 효과적입니다. 곤충 세포는 효모보다 더 고등한 진핵 세포 시스템이므로 더 ...